Neste trabalho de revisão, são apresentados as principais espécies de carrapatos comuns aos animais domésticos, silvestres e seres humanos no Brasil. São revisados o processo e a estratégia, bem como as possibilidades de transmissão dos principais agentes patogênicos causadores de doenças com destaque para os aspéctos zoonoticos. São ainda discutidos os fatores de risco da infecção humana pelas diferentes formas de babesioses, erlichioses, febre maculosa, borrelioses e viroses
Introdução
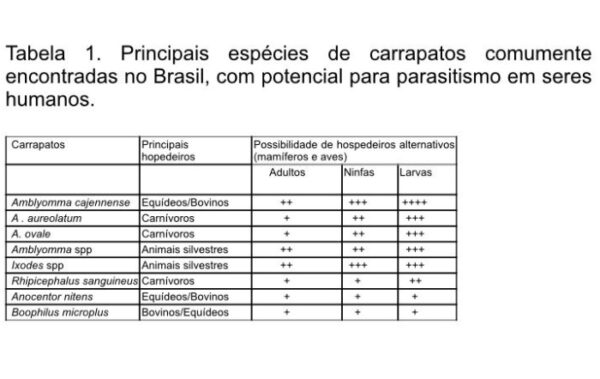
Os carrapatos considerados de importância econômica e para a saúde pública são artrópodes da classe arachnida, ordem acari e famílias ixodidae e argasidae. Todas as espécies requerem obrigatoriamente sangue de vertebrados e possuem significativo grau de especificidade podendo utilizar hospedeiros alternativos, incluindo o homem. No ambiente rural brasileiro e na periferia de áreas urbanas, é comum a presença de cães parasitados por amblyomma ovale, a. aureolatum e amblyomma spp e rhipicephalus sanguineus. Nas extensas áreas de pastagens destinadas à pecuária bovina, com rebanho constituído de mais de 169 milhões de cabeças, predomina o boophilus microplus. Na pecuária equína, constituída de aproximadamente 6 milhões de cabeças, predominam Amblyomma cajennense e anocentor nitens. Nas áreas de florestas nativas no Brasil (ainda a maior reserva do planeta), reflorestamentos, cerrados, agrestes, bem como nas regiões de lavouras primitivas e descampados, existe um potencial do parasitismo para mais de 25 espécies conhecidas, pertencentes ao gênero amblyomma, 6 espécies de ixodes, 3 espécies de haemaphysalis, além de um número desconhecido de espécies do gênero ornythodorus. Todas estas espécies são parasitas de roedores, lagomorfos, marsupiais, carnívoros, cervídeos, répteis, aves e potencialmente do homem.
Os carrapatos dos gêneros boophilus e anocentor, ao se fixarem nos hospedeiros, neles permanecem por três a cinco semanas, ocorrendo então, as fases de larvas, ninfas e adultos em um único hospedeiro. Nos demais gêneros, a fêmea é fecundada e após o ingurgitamento. A postura é única, e o número de ovos em algumas espécies, pode ultrapassar a 8.000 ovos, como no caso de carrapatos do gênero amblyomma. O número de gerações por ano é variável, dependendo da espécie, da abundância de hospedeiros e das condições climáticas da região, ocorrendo até 5 gerações nas áreas de clima tropical úmido.
As espécies do gênero amblyomma e ixodes, assumem grande importância na transmissão de patógenos, por utilizarem mais de um hospedeiro e possuírem ampla distribuição geográfica no continente americano. Trata-se de carrapatos de parasitismo eclético, cujas larvas podem ser encontradas sobre qualquer mamífero doméstico, silvestre, ave e no homem. O maior potencial e risco para transmissão de patógenos para seres humanos ocorre nas regiões de florestas, cerrados nativos, descampados e pastagens. A menor relação parasito/hospedeiro e menor grau de especificidade dos carrapatos, e longos períodos de jejum, são fatores que favorecem a transmissão de patógenos.
 O processo de alimentação e a transmissão de patógenos
O processo de alimentação e a transmissão de patógenos
O aparelho bucal do carrapato penetra profundamente na pele do hospedeiro, permanecendo fixado através do hipostômio e pela solidificação da secreção salivar. Ao provocar laceração dos tecidos e vasos sanguíneos, o carrapato ingere sangue e outros líquidos tissulares dos hospedeiros, e regurgita grandes volumes de saliva, principal via de inoculação de patógenos.
No processo de alimentação, os carrapatos causam:
a) ação traumática, pela dilaceração de células e tecidos;
b) ação mecânica, pela compressão de células;
c) espoliação direta, pelo hematofagismo;
d) ação tóxica, pela inoculação de substâncias de alto peso molecular pela saliva; além da depreciação do couro e predisposição a miíases e abscessos. Durante o processo de alimentação, os carrapatos podem transmitir microrganismos patogênicos juntamente com a saliva, constituindo-se no segundo grupo de vetores que maior número de patógenos transmitem para o homem, sendo superados apenas pelos culicídeos. A saliva é considerada a rota primária pela qual microrganismos são inoculados na corrente sanguínea dos hospedeiros (Balashov, 1972)
Estratégia de alimentação
No processo de fixação, o hipostômio penetra lentamente, como consequência da ação combinada entre as quelíceras e a saliva. A digestão dos tecidos ao redor do canal de penetração causa ruptura dos capilares e vasos linfáticos. Os carrapatos se alimentam por sucção, alternada com a eliminação de saliva, sendo que o maior volume de saliva é secretado no final do processo de ingurgitamento (Balashov, 1972). Após introdução do hipostômio na pele do hospedeiro, ocorre o processo de solidificação da saliva, formando uma lâmina hialina, concêntrica, rica em lipoproteínas e glicoproteínas. Segundo Moorhouse & Tatchell (1966), a saliva é o principal componente responsável pela fixação de carrapatos que possuem aparelho bucal curto, a exemplo das espécies dos gêneros boophilus, rhipicephalus e anocentor. Na região lesada pode ser encontrado tecido amorfo necrótico, células cutâneas e componentes do sangue. A região fica circundada por uma zona edematosa e a estrutura celular normal desaparece, gradualmente, com extravasamento de sangue por ruptura de vasos. Embora a capacidade de ingestão de sangue varie consideravelmente, as peças bucais das larvas, das ninfas e dos adultos penetram na pele dos hospedeiros na mesma profundidade. A extensão da lesão aumenta marcadamente em cada estágio, estando este fenômeno intimamente relacionado com a lise dos tecidos do hospedeiro (Tatchell & Moorhouse, 1968). A saliva contém quinases que catalisam a bradicinina, o que explica em parte a ausência de dor. As prostaglandinas presentes na saliva, inibem a produção de interleucina e a migração de macrófagos.
Nos hospedeiros sensíveis ou não previamente expostos, a principal resposta ocorre por infiltração neutrofílica ao redor do local de fixação dos carrapatos. Enzimas tipo colagenases e proteases causam necrose cutânea nos hospedeiros. O processo inflamatório resultante produz vasodilatação, ruptura dos vasos e hemorragia perto da cavidade formada na parte distal da quelícera. Ao mesmo tempo, a derme adjacente torna-se fibrosa devido a multiplicação de fibroblastos. Ocorre, ainda, degeneração celular e, a derme e a epiderme tornam-se edematosas. Os ixodídeos podem se beneficiar pela reação do hospedeiro, especialmente na fase final do ingurgitamento, com o rápido aumento da secreção salivar, aumentando a permeabilidade capilar e o afluxo de sangue (Ribeiro, 1987).
Nos hospedeiros resistentes, a lesão de fixação é mais intensa do que nos hospedeiros sensíveis, e se traduz, principalmente, por edemas na epiderme e derme no ponto de fixação, acompanhado por infiltração eosinofílica e basofílica. Ocorre decomposição de células e tecidos por necrose, sem que ocorra ruptura de vasos. A cavidade formada na parte distal da quelícera, evolui para pústula a qual é rica em basófilos e linfócitos. A degranulação de basófilos e eosinófilos liberam histamina, serotonina e heparina, as quais dificultam ou impedem os carrapatos de completarem o processo de ingurgitamento. A saliva, que possui discreto efeito de lise, associa-se à intensa reação do hospedeiro naturalmente resistente, na indução de elevada atividade antigênica.
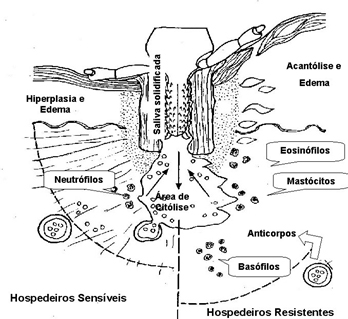
Lesão de fixação dos carrapatos e mecanismo de reação dos hospedeiros sensíveis ou não previamente expostos e hospedeiros resistentes. Adaptado de Morel (1989)
A transmissão de patógenos
Pesquisas têm revelado uma grande variedade de organismos transmitidos por carrapatos, sendo transferidos pela picada, pelos excrementos, pelo líquido coxal (em Argasidae), ou mesmo pela ingestão de carrapatos infectados. Em alguns casos funcionam como transmissores mecânicos ou simples transportadores (Walker, 1998). Dentre as modalidades de transmissão ocorrem situações diversificadas e os agentes patogênicos podem proliferar no organismo dos vetores, podendo ainda ocorrer um desenvolvimento cíclico através dos diferentes estágios evolutivos (transmissão transestadial), como também entre gerações sucessivas (transmissão transovariana). A transmissão de patógenos pode se dar ainda na forma intra-estadial.
Segundo Harwood & James (1979), os carrapatos possuem extraordinária capacidade de agirem como vetores de doenças entre os animais domésticos, silvestres, aves e o homem, pelas seguintes características biológicas: Hematofagismo em todas fases evolutivas, o que aumenta a eficiência como vetor; fixação profunda nos hospedeiros, propiciando dificuldade de remoção e facilitando a dispersão por aves e mamíferos; ingurgitamento lento, propiciando tempo para adquirir e inocular patógenos; adaptação a diferentes hospedeiros, possibilitando veiculação de patógenos entre diferentes espécies; longevidade dos estágios no ambiente, propiciando tempo para multiplicação dos patógenos; transmissão transovariana, permitindo sucessivas gerações com potencial de transmitir e funcionarem como eficientes reservatórios; poucos inimigos naturais, pela eficiente adaptação ao ambiente tropical; grande esclerotização, propiciando resistência a adversidade climática e; grande potencial biótico, possibilitando a perpetuação da espécie.
Uma das características das doenças cujos agentes são transmitidas por carrapatos, constitui-se no fato de mimetizarem um grande número de doenças infecciosas e parasitárias, o que dificulta substancialmente o diagnóstico específico e o tratamento. Em geral, os sintomas clínicos envolvem processo febril e anemia nos hospedeiros vertebrados. Muitas destas doenças podem ser classificadas como exóticas, emergentes ou re-emergentes. O seu aparecimento ocorrer de forma inesperada e depende das possibilidades de diagnóstico ora disponíveis. A carência de literatura específica em língua portuguesa é uma das responsáveis pela desinformação de razoável parcela das classes médica e médica veterinária, com relação a estas patologias, que se não forem diagnosticadas no início do processo, podem produzir perdas graves de caráter médico e/ou econômico ou ainda, a morte dos hospedeiros.

Foto: Pixabay
Principais doenças transmitidas por carrapatos
Babesioses
As babesioses são responsáveis por elevada patogenicidade para seus hospedeiros, especialmente para animais importados de áreas indenes, como também para animais estressados pela ação de outras doenças, imunossuprimidos por corticóides ou esplenectomizados. Infecções mistas de parasitos do gêneros babesia e ordem rickettsiales, são frequentes em bovinos e carnívoros. Após a picada dos carrapatos vetores, o período de incubação se completa em 10 a 20 dias, quando ocorre febre, inapetência, depressão e lacrimejamento, podendo ocorrer icterícia. Posteriormente, sobrevém marcada anemia, quando mais da metade dos glóbulos vermelhos está reduzida. A ocorrência de hemoglobinúria aparece nos quadros de acentuada gravidade. Áreas edemaciadas aparecem especialmente nas partes baixas do corpo, como membros, bolsa escrotal, vulva, baixo ventre e também na região encefálica. As fezes ficam ressecadas e com acentuada mucosidade de coloração amarelada. Pode sobrevir após estes sinais um quadro de acentuada caquexia e ocorrência de hemorragias do tipo petequia e, também, equimoses nas membranas mucosas da vagina e das narinas.
Os sintomas febris ocorrem nos cursos agudos da doença. Nos casos crônicos os sinais de febre são persistentes por várias semanas, podendo este quadro febril ser intermitente e variar de 39º C a 42º C. As pulsações podem atingir 100 batimentos por minuto, com característico pulso da veia jugular. Após o quadro agudo de um modo geral, sobrevêm um quadro sub-clínico. Nestes casos, a infecção persiste por toda a vida do animal e recrudescências ao quadro agudo podem acontecer após meses ou muitos anos da infecção. Os animais nativos, nascidos em áreas endêmicas, podem sobreviver por toda vida nestas áreas sem demonstrar sinais clínicos. A mortalidade é baixa entre animais autóctones e de áreas endêmicas, e elevadas, podendo chegar a 100% entre animais de regiões indenes, quando introduzidos em áreas enzoóticas.
Babesiose humana
Babesiose é uma zoonose transmitida por carrapatos com distribuição cosmopolita e é causada por hemoprotozoários do gênero babesia. Mais de 70 espécies pertencentes ao gênero foram descritas em animais, incluindo babesia bigemina, b. bovis e b. divergens em bovinos; b. caballi e b. equi em equinos; b. canis em cães; b. microti em roedores, e recentemente foi descrita uma nova espécie em seres humanos, a qual foi provisoriamente nominada como b. wa-1 (Quick et al. 1995).
Os primeiros autores a registrar a presença de babesia no homem, foram Wilson & Chowing (1902, 1904) os quais pesquisavam a febre maculosa das montanhas rochosas, de etiologia desconhecida naquela época, quando observaram e descreveram nas hemácias de quatro dos 23 doentes examinados, organismos identificados como sendo uma nova espécie, designada como Piroplasma hominis. Encontraram também parasitas semelhantes no roedor citellus columbianus e obtiveram inoculações positivas em coelhos. Embora o achado tivesse sido confirmado em outros pacientes e aceito por várias autoridades da época, principalmente por Wolbach (1919), a descoberta não é mais aceita, em decorrência da identificação do verdadeiro agente da febre maculosa por Ricketts (1909), reconhecido por Wolbach (1919) como sendo uma rickettsia, assim denominada em homenagem ao seu descobridor. O nome proposto por Wilson & Chowing (1902) pyroplasma hominis (Babesia hominis), embora tenha prioridade para as babesias dos seres humanos, esta não pode ser usada de acordo com as regras internacionais de nomenclatura zoológica, por não ter sido empregado por mais de 50 anos, e ser um nomen oblitum (nome esquecido). A descrição original de Wilson & Chowing (1902) tratava-se, provavelmente, de uma infecção mista por parasitos dos gêneros babesia e rickettsia, ambas transmitidas por carrapatos.
Outro caso de babesiose humana foi descrito em 1957 na Yugoslavia em um fazendeiro esplenectomizado, com 33 anos de idade. O parasitismo por b. bovis foi identificado no sangue do paciente, o qual faleceu 8 dias após o início dos sintomas como febre, anemia, icterícia e hemoglobinúria. Logo em seguida, outros três casos fatais foram registrados na literatura, todos em portadores esplenectomizadas.
O primeiro caso em paciente não esplenectomizado, foi registrado em uma senhora natural da costa leste do Estados Unidos, a qual manifestou sintomas de febre, dor de cabeça e dor abdominal, na qual foi diagnosticado b. microti. Outros casos com o mesmo parasito, nos Estados Unidos, foram confirmados em seres humanos, através de microscopia e sorologia.

Foto: Pixabay
Entre 1982 e 1993, um total de 139 pacientes foram hospitalizados com diagnóstico positivo para B. divergens no estado de New York, EUA. Segundo Talarico et al. (1998), 9 (6,5%) dos pacientes evoluíram para óbito; 35 (25,2%) foram mantidos em unidades de terapia intensiva e 35 (25,2%), foram mantidos por mais de 2 semanas hospitalizados. A idade média dos pacientes foi 62,5 anos e 91% apresentaram febre, cansaço, indisposição, mal estar e enfraquecimento. Um total de 52% dos pacientes tinham história de doença crônica. Em conclusão, a literatura considera babesiose humana na América do Norte como uma doença rara, porém, debilitante e potencialmente fatal, especialmente em humanos idosos ou imunodeprimidos. O pronto diagnóstico, tratamento precoce e o estabelecimento de profilaxia tem sido referido como situção indispensável.
O relato de babesiose na Europa, incluí cerca de 28 casos relatados na literatura, sendo que 83% dos pacientes foram submetidos a esplenectomia e em 76% foram devidos a babesia divergens. Casos esporádicos tem sido relatados na Ásia, África, Américas Central e do Sul. A babesiose humana causada pela b. microti e pela babesia wa-1, tem sido descrita com frequência nos Estados Unidos, pela b. divergens, b. bovis, b. equi, e na Europa e Ásia cdc (2003).
O primeiro caso registrado no Brasil, foi descrito por Alecrim et al. 1983, em paciente com suspeita clinica de malaria, no qual foi confirmado a presença de parasitos identificados como pertencentes ao gênero babesia. Yoshinari et al. (2003) descreveram casos de co-infeção entre babesia bovis e o agente da borreliose de lyme, em dois pacientes com 10 anos de idade, procedentes do município de Cotia, São Paulo, que apresentaram quadro de eritema migratório, febre, dor nas articulações e dor muscular. Ambos apresentaram reação sorológica positiva (elisa e western-blotting) para antígenos anti borrelia burgdorferi e anti-b. bovis da classe igm, sugerindo doença aguda. Os mesmos autores comprovaram também alta frequência de anticorpo anti-b. bovis em pacientes portadores de sorologia positiva para borreliose de lyme (Yoshinari et al. 2003).
A presença de B. bovis em seres humanos foi também registrada na Colômbia. Os autores utilizaram as técnicas de gota espessa, imunofluorescência indireta e esfregaços sanguineos para avaliar 194 indivíduos divididos em três grupos: um constituído de indivíduos com sinais clínicos de malária e outro constituído por indivíduos residentes em fazendas de gado, com ou sem sintomas da infecção, e o terceiro constituído por indivíduos trabalhadores no abatedouro local. Como resultado, foram observados três casos com anticorpos igm contra b. bovis; um com anticorpos igg, contra b. bovis; um com anticorpos igm contra b. bigemina; outro igg para b. bigemina, e um terceiro com igg e igm para b. bigemina, constituindo um total de sete casos positivos em uma amostra constituída de 194 indivíduos. Somente um dos indivíduos apresentou resultados parasitológicos e sorológicos para b. bovis.(Rios et al. 2003).
Em Cuba, a babesiose humana é frequente entre trabalhadores agropecuários, conforme demostrou Hernández et al. (1997). Estes autores observaram maior soropositividade por Imunofluorescência indireta por até 46% entre trabalhadores de atividades pecuárias, 30,7 entre trabalhadores técnicos veterinários e de 7,6 entre médicos veterinários e trabalhadores florestais.
Ehrlichioses
Os parasitos da tribo eherlichiae são organismos intracelulares obrigatórios e com tropismo por leucócitos circulantes. Eles foram descobertos por Donatien & Lestoquard (1935) no Instituto Pasteur na Argéria. A parasitose foi observada em cães domésticos infestados como rhipicephalus sanguineus, quando desenvolviam severa doença febril caracterizada como anemia. Esfregaços de sangue dos cães infectados corados pela técnica de giemsa, demostraram organismos semelhantes a pequenas rickettsias dentro dos monócitos. Os organismos estavam agregados na forma arredondada ou oval em colônias como 2 – 10 μ de diâmetro. Estes autores denominaram o novo organismo descoberto como rickettsia canis.
Posteriormente, a infecção por e. canis foi documentada em muitas áreas na região do Mediterrâneo, na Índia e em várias partes da África. Entretanto, somente muitas décadas após, E. canis foi observada no hemisfério ocidental Bool & Sutmoller (1957). Ewing (1969) também descreveu a ocorrência de e. canis em monócito de cães em Oklahoma, Estados Unidos. Os animais apresentavam hiperplasia de linfonodos, esplenomegalia e severa pancitopenia, demonstrando pronunciada hipoplasia, depleção de megacariócitos e de precursores granulocíticos. A importância na medicina veterinária, foi reconhecida durante a guerra do Vietnam, quando os cães utilizados naquela guerra apresentaram elevada morbidade e mortalidade (Huxsol et al. 1969). A partir desta época a doença passou a ser diagnosticada em todas regiões dos Estados Unidos, Europa, Ásia e Américas, inclusive no Brasil, estando relacionada a presença do carrapato vetor r.sanguineus.
Segundo Ewing (1969), e.canis é um microrganismo específico de glóbulos brancos, e por isto causa patologias severas para os hospedeiros. Essencialmente, produzem inibição do sistema imune e de funções básicas na medula óssea. Tanto em humanos, quanto nos animais, a morte de células é maior do que a capacidade da medula óssea de promover sua reposição, sendo observado células imaturas na corrente circulatória. Este fato frequentemente torna difícil o diagnóstico com quadro de leucemia ou linfossarcoma.
A primeira descrição de infecção por ehrlichia no homem foi realizada por Maeda et al. (1987), a qual foi reconhecida como causadora de infecção primária no homem. Esta espécie tem relações biológicas próximas a e. equi e e. phagocytophila, diagnosticadas, respectivamente em equideos e ruminantes e ambas, também, diagnosticadas em seres humanos. Abaixo, estão relacionadas as diferentes espécies descritas, respectivos hospedeiros, transmissores e célula parasitada.
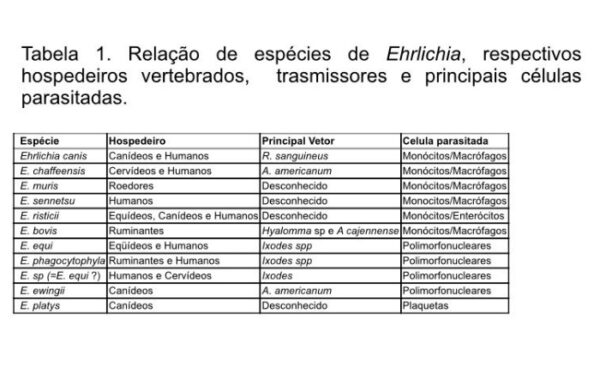
Mecanismo de Transmissão
Exceto e. risticii, a transmissão ocorre após contato com carrapatos. Moscas hematófagas, pulgas e mosquitos, são considerados possíveis vetores. Os reservatórios incluem roedores e outros mamíferos expostos ao contato com carrapatos.
Doença clínica
A doença evolui em três fases. A primeira é aguda e mimetiza infecção viral. Os sinais clínicos podem passar despercebidos. Na ausência de tratamento, ocorre evolução para a fase subclínica (segunda fase) ou pode evoluir para fase crônica (terceira fase), também conhecida como pancitopenia tropical canina. A causa mortis em ehrlichiose, está frequentemente associada a hemorragia interna, severa doença autoimune e múltiplas infecções secundárias, devido ao comprometimento do sistema imune e falência múltipla de um ou mais órgãos internos, como coração, fígado, baço, etc. Uma das marcantes ações da ehrlichiose é a redução dos elementos celulares do sangue. Embora os organismos vivam e se reproduzam nas células brancas (leucócitos) eles causam forte efeito no sistema linfático e potencialmente afetam múltiplos órgãos e sistemas. A severa depressão do sistema imune propicia condições para instalação de infecções bacterianas ou viróticas secundárias, levando ao emagrecimento, tosse, fadiga, febre intermitente, depressão, anorexia, dor nos gânglios linfáticos (Eng et al. 1988).
Na Venezuela foi descrito um caso de ehrlichiose humana e os clássicos sinais da doença, tendo sido demonstrado a presença de mórulas em plaquetas, semelhantes a e.platys. (Almosny 2002).
O elemento que torna a ehrlichiose particularmente severa, é sua capacidade de mimetizar outras patologias. A detecção da doença é possível através do teste de imunofluorescencia indireta, elisa ou imunobloting, que detectam a presença de anticorpos. Existe a possibilidade de teste negativo na fase aguda ou na fase crônica, na hipótese de baixo nível de anticorpos. Na fase aguda é possível a demonstração de colônias nas células parasitadas, em esfregaço finos, fixados em metanol e corados pelo giemsa ou panótico rápido.
Febre maculosa
O agente etiológico da febre maculosa, rickettsia rickettsi, está intimamente relacionado com seus hospedeiros vertebrados. Os cães atuam como carregadores de carrapatos de animais silvestres para o peridomícilio, e constituem-se em importantes indicadores da atividade do agente etiológico. A lista de animais soro positivos é extensa, e inclui os cachorros do mato, préas, lebres, esquilos, roedores silvestres e marsupiais. Aparentemente, estes dois últimos e os carrapatos neles encontrados, constam-se no ecossistema natural, onde a r. rickettsi pode perpetuar-se. A elevada labilidade da r. rickettsi em hospedeiros secundários, justifica a dificuldade deste agente de atingir níveis de endemicidade. A eficiente transmissão transovariana, indica que os carrapatos constituem-se em excelentes reservatórios na natureza (Lemos Monteiro et al. 1932).
Estudos conduzidos em áreas endêmicas nos Estados Unidos, indicaram que a temperatura ambiente, umidade relativa, vegetação tipo arbustiva e floresta decídua, propiciam condições ecológicas favoráveis. No Brasil não existem estudos sistematizados sobre a ecologia da febre maculosa. (Sexton et al. 1993) demonstraram a existência desta doença no município de Colatina, no estado do Espírito Santo, com ocorrência de 4 óbitos. Segundo os autores, a localidade estudada está situada em um vale com predominância do cultivo de café, a cerca de 30 km distante da cidade de Colatina. Todos pacientes que vieram a óbito, participaram de caçadas a animais silvestres e havia registro de grande quantidade de carrapatos em suas roupas e no corpo. Neste mesmo vale, 25 cães foram testados para anticorpos r. rickettsi, e 2 deles, apresentaram elevados títulos e eram animais de estimação na residência onde ocorreram os óbitos. Os demais cães apresentaram baixa sorologia e não tinham história de participarem de caçadas.
Os dados disponíveis indicam, segundo Lemos et al. (1994) que os focos conhecidos estavam relacionados com o ambiente rural, vegetação rasteira ou arbustiva, lavouras rudimentares e presença constante de cães. É provável que o número de casos conhecidos em nosso país seja significativamente menor do que a real incidência da doença (Lemos et al. 1994). Nas últimas décadas, a febre maculosa tem sido relatada em todos continentes, sempre em forma de pequenos surtos com morbidade e mortalidade mais ou menos grave, na dependência do tempo utilizado para diagnóstico, e na pronta administração de tratamento específico. Lemos et al. (1994) assinalaram um caso clínico fatal confirmado por imunofluorescência específica. Com o intuito de obter-se informações sobre a ricketsiose transmitida por carrapato, estes autores realizaram estudo epidemiológico no município de Santa Cruz do Escalvado, localizado na zona da mata do estado de Minas Gerais. Amostras de sangue obtidas de 672 pessoas e de 95 cães, foram testadas pela reação de imunofluorescência indireta para a pesquisa de anticorpos para a ricketsiose do grupo da febre maculosa. A soro-positividade foi detectada em 7,14% da população humana estudada, na ausência de doença prévia conhecida, e em 13,68% da população canina. Foi realizada a investigação dos carrapatos coletados de humanos, animais e de vegetação em nove localidades do Município. De um total de 1.254 carrapatos coletados em animais e na vegetação, 1.061 pertenciam ao gênero amblyomma. 57 destes artrópodes pertenciam, respectivamente, às espécies rhipicephalus sanguineus, boophilus microplus e anocentor nitens. Somente três carrapatos da espécie a. cajennense foram coletados em humanos.
Segundo Lemos et al. (1995), de 42.010 carrapatos coletados na região de Campinas, Pedreira e Jaguariúna, 99% pertenciam ao gênero amblyomma. Nesta região tem sido frequente o diagnóstico laboratorial clínico da febre maculosa brasileira, além da ocorrência de alguns óbitos.
Lima et al. (2003), publicaram o histórico da situação da febre maculosa na região administrativa de Campinas no, estado de São Paulo. Segundo os autores, esta doença foi detectada pela primeira vez no estado de São Paulo, em 1929, sem registro sistemático dos casos. A maioria dos pacientes identificados, referem-se a picada de carrapatos, porém, a falta desta informação não exclui a possibilidade da doença, pelo fato de passarem despercebidos. Os dados disponíveis no Brasil indicam que a maior prevalência desta doença ocorre nos meses secos e frios, coincidindo com a maior prevalência dos carrapatos vetores.
A doença no homem pode ser aguda, febril e do tipo exantematosa, ou com sintomas inaparentes, mimetizando o estado gripal. A ocorrência de lesões cutâneas deve-se à colonização do endotélio dos pequenos vasos pela r. rickettsi, formando trombos, hemorragias, infiltração perivascular e necrose focal. A literatura específica registra lesões no miocárdio, pele e tecido cerebral, com quadro de vasculite necrosante. O período de incubação varia de 3 a 14 dias e o início é súbito, com febre, dor de cabeça, prostração, mialgias e confusão mental. A presença de exantema maculopapular pode ser observada a partir do 3o ou 4o dia, iniciando nas extremidades, punho, tornozelo, irradiando-se para tronco, pescoço e face. A doença evolui para gravidade em 2 a 3 semanas, com aparecimento de necrose nas áreas de sufusões hemorrágicas, em decorrência da vasculite generalizada. Os casos fatais causados pela febre maculosa diminuíram drasticamente após a descoberta da tetraciclina e do cloranfenicol. Segundo a literatura, nas décadas de 30 e 40, ultrapassava 20% e após a década de 80, tem sido menor que 5%, quando o tratamento é feito em espaço menor que 6 dias, após a inoculação do patógeno Lima et al. (2003).
Borrelioses
As espécies de borrelias patogênicas, acometem o homem, mamíferos domésticos e silvestres, além de aves. Como membro da ordem spirochaetales, a família spirochaetaceae distinguem-se morfologicamente de leptospira e Treponema, por serem maiores, possuírem maior número de flagelos periplasmáticos e menor número de espiras. Estes agentes reproduzem por fissão binária transversal, são microaerófilos, o que os distingue dos demais gêneros, pois a maioria é aeróbico. Coram-se pelos corantes derivados da anilina e do romanovski, são gram-negativas, crescem à temperatura de 33°C, em meio bsk, e podem ser visualizadas através de microscopia ótica de campo escuro Johnson et al. (1984).
As borrelias conhecidas, determinam cinco grupos de enfermidades distintas:
(a) febre recorrente humana, ocasionada pelo grupo da b. recurrentis, lato sensu, com mais de vinte espécies. Esta é considerada uma das mais antigas doenças transmitidas por artrópodes;
(b) borreliose aviária, determinada por uma única espécie, b. anserina, a qual causa processo anemiante febril, depressão e altas taxas de morbidade nas aves infectadas;
(c) borreliose bovina, causada pela b. theileri. Esta espécie é cosmopolita e pode determinar anemia em ruminantes e equinos, sendo considerada pouco patogênica;
(d) orreliose de lyme, causada pelo grupo da b. burgdorferi lato sensu, com sete espécies definidas (Johnson et al. 1984);
(e) borto enzoótico bovino, enfermidade que acomete bovinos e cervídeos, determinada pela b. coriaceae (Johnson et al. 1987).
A borreliose de lyme é uma enfermidade infecciosa sistêmica, causada pela espiroqueta borrelia burgdorferi lato sensu, e transmitida por carrapatos ixodídeos. Apresenta ampla distribuição geográfica, sendo reconhecida na América do Norte, Ásia, Austrália e América do Sul (Yoshinari et al. 1997). A associação da borrelia com carrapatos, parasitos de roedores e aves migratórias, possibita uma ampla distribuição geográfica do agente, incluindo áreas onde a doença está ausente em humanos. A infecção inicia-se no local da inoculação dos microrganismos, originando lesão cutânea característica denominada eritema cutâneo. Na fase de disseminação das borrelias surgem lesões secundárias, febre, adenopatia, calafrios, mialgias e artralgias, caracterizando o estágio primário ou agudo. Na fase latente ou tardia, meses ou anos após o contato inicial, podem ocorrer complicações como artrite reumatoide, miocardite ou neuropatias (Steere et al., 1983). O diagnóstico clínico em animais é difícil, pois os sinais se assemelham aos de outras enfermidades.
Yoshinari et al. (1989), publicaram o primeiro artigo de revisão sobre borreliose em língua portuguesa, quando alertaram a classe médica sobre a possibilidade da existência desta enfermidade no Brasil. O perfil desta borreliose foi caracterizado no Brasil por Yoshinari et al. (1997), tendo sido relatado a ocorrência de aproximadamente 30 casos em humanos, quando foi discutido a clínica, o diagnóstico sorológico, o tratamento e a epidemiologia com o envolvimento de cães, bovinos, animais silvestres e carrapatos. Estudos soro-epidemiológicos de borrelioses foram realizados em humanos, em bovinos, em cães e em equinos, e a soroprevalência em todos os estudos apresentaram valores próximos aos reportados em áreas endêmicas na América do Norte (Yoshinari et al., 1995; Yshikawa 1996, 1999; Soares et al.1999; Salles et al. 2001). Fonseca et al. (1995) relataram altos títulos de anticorpos contra b. burgdorferi em bovinos e caninos provenientes do estado do Rio de Janeiro e Espírito Santo, e diagnosticaram e isolaram espiroquetas em gambás no município de Itaguaí, estado do Rio de Janeiro. Yoshinari et al. (1995) realizaram um trabalho retrospectivo sobre borreliose de lyme no Brasil, caracterizando-a como uma zoonose emergente de interesse multidisciplinar. Relataram a identificação e estudo de 25 pacientes portadores desta borreliose, e discutiram aspectos clínicos, sorológicos e epidemiológicos desta enfermidade no país.
Barboza et al. (1999) detectaram gambás naturalmente infectados, após imunossupressão com ciclofosfamida. Os animais não apresentaram infestação por carrapatos ou outro ectoparasito e não foi detectado sinal ou sintoma de doença. Através da histopatologia, foi verificado infiltrado linfocitário nos rins dos camundongos inoculados com macerado de rim de gambá positivo. A presença de borrelia sp no sangue periférico destes camundongos, sugere que estes animais podem servir como modelo experimental. O interesse no estudo de patologias associadas aos marsupiais deve-se à diversidade de nicho ecológico peridomiciliar, facilidade de manuseio e adaptação às condições de cativeiro.
Estudos conduzidos por Ishikawa et al. (1999), indicaram que de 513 amostras de soro bovino analisadas pelo teste elisa indireto, 16 (13,12%) apresentaram anticorpos igg contra b. burgdorferi com título 1/800, 292 (56,92%) com título 1/400 e 205 (39,96%) foram negativos. A maior percentagem de animais soropositivos foi observado no grupo proveniente do município de Alegre, estado do Espírito Santo. Neste município, foi verificado um bezerro com claudicação e outro com aumento de volume da articulação rádio-carpiana, ambos da mesma propriedade e com sorologia positiva no teste elisa. Nesta região também foram identificados casos humanos com suspeita clínica e sorologia positiva (elisa e “Western blotting”) reforçando a possibilidade de se tratar de uma área de risco para existência da borreliose de lyme.
O teste elisa indireto, realizado em 150 amostras de soros de cães aparentemente sadios, indicaram que 30 (20%) foram reagentes ao elisa indireto, das quais 20 (13,34%) apresentaram títulos de 1400, quatro (2,66%) a 1800 e seis (4,00%) com título de 1600; totalizando 120 (80%) amostras negativas. (Soares, 1999).
Os animais domésticos e silvestres apresentam maior risco em adquirir o agente etiológico porque são parasitados por grande número de carrapatos e/ou estão expostos a inúmeros artrópodes hematófagos. Em áreas endêmicas b. burgdorferi tem sido encontrada em animais assintomáticos, os quais podem servir de reservatório para o homem. Considerando ainda o potencial da transmissão do agente etiológico pela urina do hospedeiro, a borreliose de Lyme deve ser tratada como sério problema envolvendo a saúde pública (Soares et al., 1999). Yoshinari et al. (2003), confirmaram a coexistência de anticorpos anti-b. burgdorferi e anti-Babesia bovis em dois pacientes procedentes do Município de Cotia, estado de São Paulo. As duas crianças tinham história antecedente com carrapatos e apresentavam lesões cutâneas do tipo eritema migrans, febre, artralgia, mialgia, apresentando altos títulos para ambos agentes etiológicos.
Nos ruminantes, segundo Wells et al. (1993), a borreliose de lyme promove aumento de volume articular, mialgia, febre, laminite, queda de produção e aborto. Na América do Norte a soroprevalência da borreliose de lyme em bovinos assintomáticos pode chegar a 75%, no Japão está em torno de 25%.
O diagnóstico de borrelia pode ser realizado em animais através de esfregaços sanguíneos periféricos, como foi utilizado na borreliose aviária, e ainda se usa para muitos hematozoários, entretanto, faz-se necessário alta parasitemia e a disponibilidade de microscopia de campo escuro. Os esfregaços podem ser realizados a partir de fragmento de tecidos do carrapato como intestino, glândula salivar e ainda hemolinfa, corados pelo giemsa como foi originalmente a observação da b. burgdorferi e, muito utilizada no estudo da b. anserina e b. theileri no carrapato. O método elisa indireto tem sido amplamente utilizado para pesquisa de anticorpos anti-carrapatos em humanos, nas áreas de áreas de risco, ou enzoótica para borreliose de lyme, babesiose humana e ehrlichiose humana; servindo como suporte para o conhecimento epidemiológico das enfermidades, além da interação do carrapato com o patógeno, através de anticorpos anti-saliva.
A penicilina, a ampicilina e a amoxicilina são efetivas por possuírem melhor absorção; mas a a doxicilina é a mais indicada devido à sua característica lipoprotéica, penetrando nos tecidos. Existem vacinas comerciais para cão com bacterinas íntegras (completas), vacinas com subunidades de proteínas, contendo principalmente, as proteínas de superfície deste agente etiológico.
Foto: Pixabay
Principais vírus e viroses transmitidos por carrapatos
Cerca de 20 diferentes espécies de vírus foram demonstradas como adaptadas a diferentes espécies de carrapatos, as quais são responsáveis por importantes patologias em animais e em seres humanos, e são denominadas genericamente de arboviroses transmitidos por carrapatos.
No Brasil, Figueiredo et al. (1999), ao identificar nove espécies de carrapatos ixodídeos sobre vertebrados domésticos e silvestres, analisou o potencial de algumas delas em transmitir patógenos para o homem e relatou pela primeira vez o isolamento de um flavovirus de amblyomma cajennense, coletado de uma capivara doente. A atividade patogênica deste vírus não foi analisada, porém o autor considerou como um novo vírus.
Existe consenso sobre a deficiência da capacidade instalada de laboratórios credenciados no Brasil para a correta identificação de patologias que mimetizam o estado gripal e síndromes hemorrágicas. Via de regra, o diagnóstico clínico “provisório” na prática médica e médica veterinária é de virose inespecífica, o que dificulta o conhecimento técnico-científico nesta área.
Doença da floresta de kyassanur (dfk) e febre omsk (fho)
Doença da floresta de kyassanur (dfk) e febre omsk (fho), estas viroses ocorrem principalmente na Índia e região oeste da Sibéria, respectivamente, sendo caracterizadas por hemorragias e encefalites. A dfk, está limitada ao estado de Karnataka na Índia, espalhada em três distritos florestais. O Carrapato vetor é o estagio ninfal do haemaphysalis spingera. Pequenos mamíferos terrestres, morcegos e aves são naturalmente infectados na região. O gado bovino, levado para a região infestada, não se infecta, porém serve de hospedeiro para os carrapatos vetores. Os carrapatos infectados também podem se alimentar em macacos que se tornam virêmicos e, com frequência morrem. O homem, ocupante ou morador das regiões florestais endêmicas, infectam-se acidentalmente Sreenivasan (1986).
A fho ocorre principalmente na região lacustre da Sibéria, onde o carrapato vetor é o dermacentor pictus, o qual se mantém na natureza em pequenos mamíferos, como os ratos, os quais transmitem esta doença para os caçadores de animais silvestres através do contato direto, independente da picada do carrapato. No vetor, a transmissão ocorre por via transovariana e trasestadial. Na década de 40, centenas de casos desta patologia foram registrados e atualmente a doença não tem sido notificada. Estas patologias induzem febre alta, cefaléia, lesões vesiculares na boca, mialgias e prostração, que podem durar de uma a duas semanas. Hemorragias ocorrem nos casos de maior gravidade em nível pulmonar, intestinal, uterina e nasal. A taxa de mortalidade pode chegar a 10%. Não há registro de sequelas.
Febre hemorrágica do Congo e da Criméia
Esta patologia está registrada na Ásia, Europa e África. A mortalidade é alta e surtos hospitalares são comuns nas regiões estudadas. O agente causal é um Vírus do gênero nairovirus, da família bunyaviridae. Em laboratório, este vírus pode ser cultivado em inúmeros sistemas de cultivo celular, como também em camundongos jovens. Esta virose é transmitida na natureza por carrapatos dos gêneros hyalomma,, rhipicephalus, boophilus e amblyomma. A transmissão nos carrapatos ocorre por via transovariana e transestadial, sendo transmitido por lebres, ouriços, ovinos e bovinos. Outros animais silvestres como girafas, rinocerontes, antílopes, búfalos, canídeos e equídeos também se infectam. Os focos principais estão localizados na região do sudeste asiático, Oriente Médio e na maioria dos países africanos, na região sub saariana até a África do Sul. Os profissionais das áreas de saúde, especialmente nos parques zoológicos, correm elevados riscos, pois além dos carrapatos vetores, pode ocorrer a contaminação por contato direto com sangue e tecidos infectados.
A manifestação clínica desta patologia pode ser caracterizada por febre, cefaleias graves, mialgias, dor abdominal, náuseas, diarreia, vômitos, fotofobia, confusão mental, agressividade, leucopenia, trombocitopenia e erupções cutâneas. Casos de hemorragias cerebrais, hepáticas e renais são indicativos de gravidade que podem levar a morte. Os pacientes suspeitos devem ficar em isolamento e os profissionais de saúde devem usar roupas especiais protetoras, bem como respiradores. Não há tratamento específico e a mortalidade pode atingir a 50% dos casos (Swepherd et al. 1989).
Virose de Powassan
O agente causal é um vírus da família togaviridae, diagnosticado no hemisfério Norte, incluindo Canadá, Estados Unidos, México e Rússia (Lvov, 1978). A infecção subclínica ocorre em mustelídeos, marmotas, esquilos, roedores e leporídeos. Na fronteira Americana, os carrapatos vetores estão incluidos nos gêneros ixodes e dermacentor, enquanto que na Rússia, o carrapato transmissor está classificado no gênero hemaphysalis (Acha & Szyfres, 1986). A doença no homem manifesta clinicamente por febre e encefalites.
Louping ill
Doença viral originalmente de ovinos, conhecida na Escócia desde o ano de 1913, tendo sido inicialmente confundida com outra doença transmitida por carrapatos causada pelo cytoecetes pahogocytophila, hoje denominada anaplasma pahogocytophila. A origem viral desta doença foi reconhecida em 1931. Surtos epidêmicos ocorrem no Reino Unido, especialmente nas regiões de montanhas. Outras espécies de animais domésticos e o homem, são considerados susceptíveis desenvolvendo doença severa e mesmo fatal (Reid, 1988). Os carrapatos vetores naquela região estão classificado como ixodes ricinus. Nos ovinos, os sinais clínicos estão relacionados com incoordenação motora, ataxia, incoordenação muscular e tremores. Nos casos de regiões com alta densidade de carrapatos, a taxa de mortalidade pode atingir 100%. Na epidemiologia desta doença o envolvimento de roedores, aves migratórias, animais silvestres e animais domésticos possibilitam a ocorrência de surtos em áreas distantes.
Febre do Carrapato do Colorado
Trata-se de virose causada por um reoviridae, originalmente encontrado nos Estados Unidos e Canadá. Atualmente tem sido encontrado em várias parte do mundo (Leduc, 1987). Os reservatórios naturais são esquilos, e outros mamíferos silvestres. O carrapato vetor entre estes animais e, destes para o homem, é o dermacentor andersoni na forma transestadial. (Emmons, 1988). A enfermidade em humanos é geralmente de caráter benigno com quadro febril, cefaléia e mialgias, que lembra a dengue. Em crianças com menos de 10 anos pode ocorrer casos de hemorragias e encefalites graves, ocorrendo principalmente nas épocas de primavera e verão. Outras espécies de carrapatos, como d. occidentalis, otobius lagophilus e haemaphysalis leporispalustres, são também encontrados naturalmente infectados com o vírus.
Doenças hemorrágicas virais observadas na África e América do Sul
Patologias febris agudas caracterizadas por hemorragias, mialgias e choque, com elevadas taxa de mortalidade, tem sido registradas na Argentina, Bolívia, Brasil e Venezuela. Os roedores têm sido considerados reservatórios e disseminadores destes vírus, através de sua urina com destaque para os gêneros calomys, akodon, sigmodon e mastomys. Acredita-se que o homem infecta-se ao inalar ou ingerir excrementos desses animais juntamente com os alimentos, ou ainda pelo contato direto do vírus com lesões na pele ou mucosas. Na Argentina, a contaminação humana foi relacionada aos catadores de milho nas províncias de Córdoba e Buenos Aires, onde epidemias envolvendo centenas a milhares de trabalhadores rurais são registrados anualmente. Na Bolívia eram comuns na década de 60, porém após a adoção de medidas de controle para roedores, a doença foi reaparecer somente em 1994. As designações sabiá, guanarito, machuco, junin e lassa, são os nomes comuns dessas viroses nas diferentes regiões na América do Sul e Oeste Africano. A patogenia destas viroses pode ser caracterizada principalmente por hemorragias capilares bem evidentes, porém sem inflamação. O tipo lassa, representa de 10% a 16% dos casos estudados e das internações em adultos, pois a febre de lassa, reconhecida desde 1969, já tem sido diagnosticada também em países africanos como Serra Leoa e Niger. As manifestações clinicas em todas regiões estudadas apresentam muitas semelhanças, destacando-se a conjuntivite, edema facial, exantema na região toráxica, pescoço e cabeça, com poliadenopatia cervical e petéquias nas axilas. Não há registro de hicterícia nem hepatoesplenomegalia, porém ocorre leucopenia, trombocitopenia e albuminúria, com cilindros característicos. Nos casos de maior gravidade, ocorre bradicardia, desidratação, queda de pressão, e hemorragias graves no útero, estômago e bexiga. Nas formas sul americanas das viroses, são comuns as hemorragias grave, porem na febre de lassa, o percentual de casos hemorrágicos não supera a 17% dos casos estudados. A morte em geral, ocorre devido a uremia ou ao choque hipovolêmico. Na febre hemorrágica boliviana, os sinais neurológicos atingem 59% dos pacientes. Estas patologias virais não têm relação direta com artrópodes. Porém, o contato com carrapatos ingurgitados e colhidos de animais doentes pode ser uma real fonte de infecção (Acha & Szsfres 1986).

